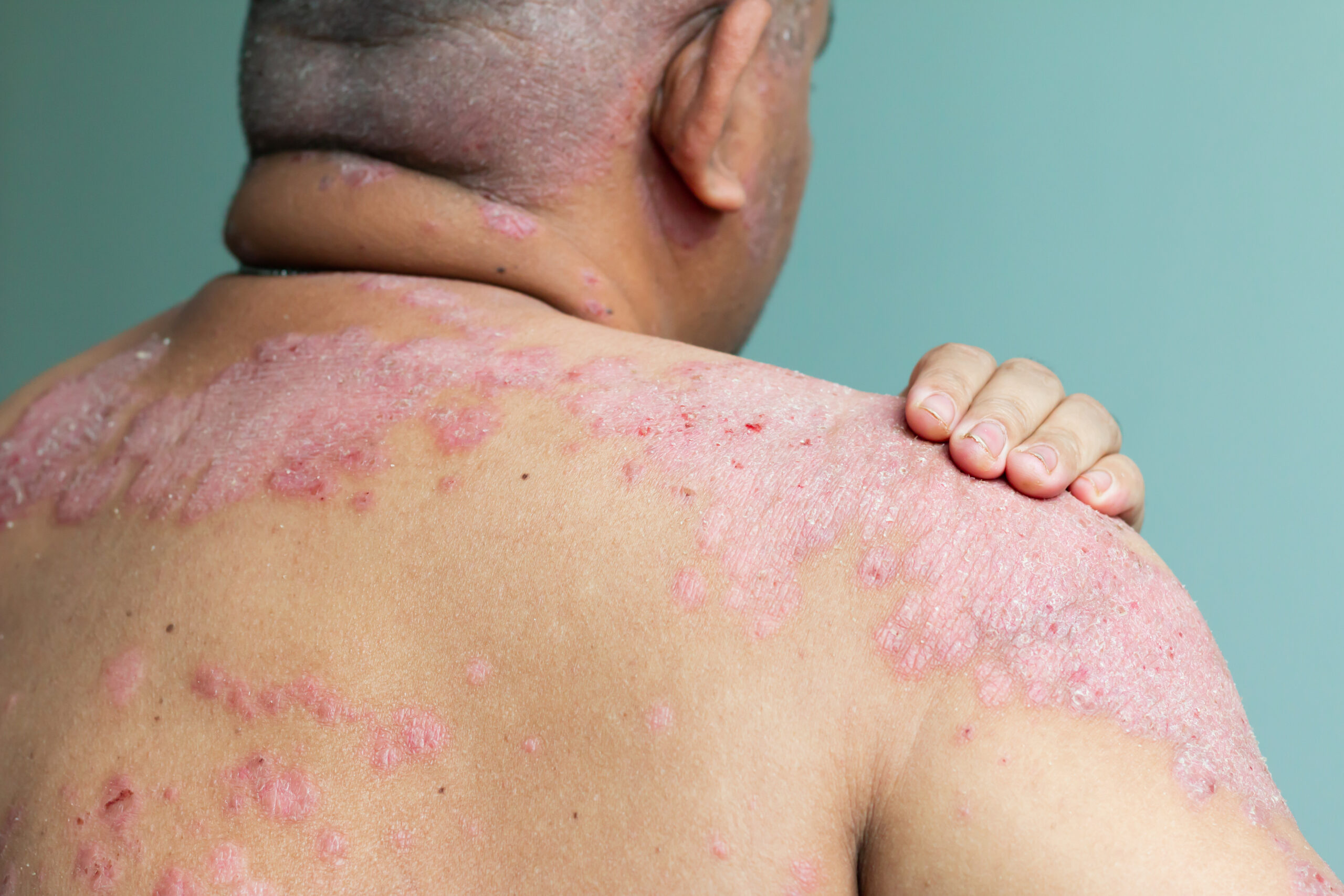
Ein neuer oraler Interleukin-Rezeptor-Antagonist zur Behandlung von Psoriasis liefert in der klinischen Phase-2-Studie vielversprechende Ergebnisse bei mittelschweren und schweren Formen der Erkrankung. Das Auftreten unerwünschter Ereignisse befindet sich auf Placebo-Niveau.
Monoklonale Antikörper, auch als Biologika bezeichnet, haben die Behandlung verschiedener immunvermittelter entzündlicher Erkrankungen wie der Psoriasis grundlegend verändert. Allerdings handelt es sich bei Biologika um große Proteine, die im Magen-Darm-System zerstört werden und daher als Injektion oder Infusion verabreicht werden müssen. Eine mögliche Behandlungsstrategie bei Psoriasis ist die Blockade des Interleukin-23-Signalwegs. Diese wurde bei der Entwicklung eines neuartigen Wirkstoffs zur oralen Therapie von Psoriasis verfolgt.
Wirksam bei mittelschwerer bis schwerer Psoriasis
In einer klinischen Studie der Phase 2 (finanziert von Janssen, einer Tochter von Johnson&Johnson) zur Dosisfindung wurden Personen mit mittelschwerer oder schwerer Plaque-Psoriasis der Behandlung mit entweder Placebo oder der neuartige Wirkstoff JNJ-77242113 in verschiedenen Dosierungen zugewiesen. Die Behandlung erfolgte über 16 Wochen. Vorrangig untersuchten die Wissenschaftler:innen die Wirksamkeit der Behandlungen anhand des Schweregrads der Psoriasis (Psoriasis Area and Severity Index, PASI, Skala von 0 – 72), mit höheren Werten entsprechend einer schwereren Psoriasis typischerweise mit größerer betroffener Hautfläche. Die Analyse konzentrierte sich auf das PASI75-Ansprechen in Woche 16, also einer Senkung des PASI-Scores um 75 % im Vergleich zum Studienbeginn.
Insgesamt nahmen 255 Patient:innen an der Studie teil. Der durchschnittliche PASI-Score zu Beginn der Studie betrug 19,1. Im Mittel litten die Patient:innen seit 18,2 Jahren an Psoriasis, 78 % von ihnen waren bereits zuvor systemisch behandelt worden. In Woche 16 erreichte ein größerer Anteil der Patienten mit JNJ-77242113 das PASI75-Ziel im Vergleich zur Placebogruppe, mit einem signifikanten Dosis-Response-Zusammenhang.
Deutlicher Erfolg nach 16 Wochen Therapie
Anteil der Patienten mit PASI75 nach 16 Wochen:
- JNJ-77242113
- 25 mg täglich: 37 %
- 25 mg 2x täglich: 51 %
- 50 mg täglich: 58 %
- 100 mg täglich: 65 %
- 100 mg 2x täglich: 79 %
- Placebo: 9 %
Die häufigsten unerwünschten Ereignisse waren Infektionen mit dem neuen Coronavirus (Placebo: 12 %; JNJ-77242113: 11 %) und Schnupfen (Placebo: 5 %; JNJ-77242113: 7 %). Vergleichbar viele Patient:innen hatten mindestens ein unerwünschtes Ereignis in Placebogruppe (51 %) und Wirkstoffgruppen (52 %). Die Studie fand keine Hinweise auf eine dosisabhängige Steigerung unerwünschter Ereignisse mit JNJ-77242113.
Nach 16 Wochen der einmal oder zweimal täglichen oralen Behandlung mit dem Interleukin-23-Rezeptor-Antagonist JNJ-77242113 zeigte sich somit eine größere Wirksamkeit im Placebovergleich ohne Zunahme unerwünschter Ereignisse bei Patient:innen mit mittelschwerer oder schwerer Psoriasis. Die klinische Studie der Phase 2 zur Dosis-Findung bietet somit vielversprechende Ergebnisse für größere Phase-3-Studien.
MEDWISS.ONLINE/PUBMED